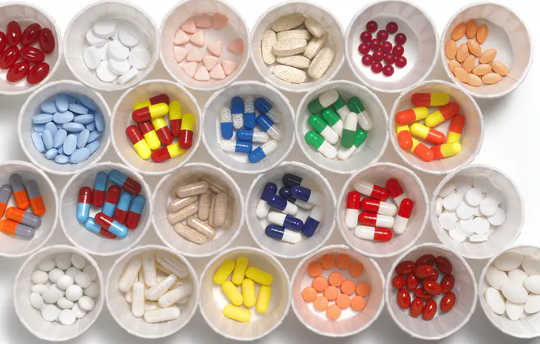
Il y a beaucoup plus d'ingrédients dans chaque pilule que vous prenez que ce qui est indiqué sur l'étiquette du flacon. Ces autres ingrédients, qui sont associés au médicament thérapeutique, proviennent souvent du monde entier avant d'atterrir dans votre armoire à pharmacie et ne sont pas toujours bénins.
Plus tôt cette année, le Congrès américain a adopté la Loi sur l'aide, les secours et la sécurité économique contre le coronavirus, qui oblige les fabricants à signaler les pénuries de médicaments réelles ou potentielles à la FDA. Les fabricants sont désormais tenus de signaler les perturbations dans la fabrication d'un ingrédient pharmaceutique actif - la partie du médicament qui produit le bénéfice thérapeutique escompté.
Mais la loi CARES n'inclut pas les excipients - les ingrédients «inactifs» qui constituent l'essentiel d'un médicament final. Il n'inclut pas non plus les matériaux nécessaires pour emballer et distribuer les produits médicaux, tels que les flacons et autres contenants, les emballages et les étiquettes. Bien que la loi CARES améliore la circulation de l'information et puisse signaler d'éventuelles pénuries de médicaments, elle vise à soutenir les organismes de réglementation (comme la FDA) dans leurs responsabilités en matière de santé publique. Il n'augmente pas la transparence pour les consommateurs de médicaments.
En tant que pharmacien et chercheur de formation intéressé à découvrir les risques pour la qualité des médicaments, je pense que les patients et les cliniciens gagneraient à avoir plus d'informations sur tous les ingrédients de la médecine. Mais pour que cela se produise, des mesures supplémentaires sont nécessaires pour augmenter la transparence pour tous les composants d'un médicament, y compris les excipients.
Étiquetage des produits pour les ingrédients `` inactifs ''
En tant qu'ingrédients dits «inactifs» dans les médicaments, les excipients sont souvent considérés à tort comme exempts de dommages potentiels. Mais les preuves suggèrent le contraire. Entre 2015 et 2019, les professionnels de la santé, les patients et les fabricants ont déposé près de 2,500 rapports à la FDA à propos d'une réaction indésirable à un excipient.
Bien que les excipients soient répertoriés sur l'emballage ou la notice des médicaments en vente libre et sur ordonnance, ces informations peuvent être difficiles à trouver. De plus, les patients passent souvent d'une version de marque à une version générique, ou le pharmacien remplace un fabricant par un autre. Bien que l'ingrédient pharmaceutique actif reste le même, les excipients peuvent être différents, et même des différences apparemment légères peuvent avoir un impact significatif sur la sécurité des patients. Par exemple, un patient peut être allergique à un excipient dans le médicament nouvellement rempli avec un fabricant différent.
Les excipients sont des matériaux critiques et remplissent une grande variété de fonctions. Ils servent de charges, aident le corps à absorber le médicament et ajoutent de la saveur ou de la couleur aux médicaments. En fait, certains se retrouvent souvent dans les produits alimentaires, tels que le lactose, l'huile d'arachide et l'amidon. Aux États-Unis, les excipients sont approuvés par la FDA dans le cadre du processus d'examen du médicament fini; ils sont considérés par l'organisme de réglementation comme généralement reconnus comme sûrs ou «GRAS». Cependant, une image complète de leur effet clinique reste incertaine.
Des recherches du MIT et du Brigham and Women's Hospital ont révélé que 92.8% des médicaments oraux contiennent au moins un allergène potentiel, une préoccupation pour les personnes ayant des sensibilités et des intolérances connues. Mon récent un article, enquêtant sur la sécurité des excipients dans les produits biologiques, qui sont de grandes molécules complexes qui sont principalement administrées par injection, a trouvé des rapports de cas de réaction au site d'injection, de réaction allergique grave, de pic de sucre dans le sang et d'insuffisance rénale aiguë associée à ces «inactifs» Ingrédients.
Malgré certaines preuves que les excipients sont responsables de réactions médicamenteuses, la quantité de chaque excipient ajouté à chaque médicament n'est pas rapportée pour près de la moitié des médicaments biologiques. En fait, notre étude a révélé que 44.4% des étiquettes des produits biologiques n'indiquent pas la concentration des excipients les plus courants. Cela est vrai pour tous les médicaments sur ordonnance, pas seulement pour les produits biologiques.
Ce manque d'informations a des implications importantes pour les patients souffrant de maladies entraînant des restrictions alimentaires - telles que l'intolérance au gluten ou au lactose, les allergies alimentaires ou le diabète - car la quantité d'amidon de blé, de lactose, d'huile d'arachide et de glucose dans leur médicament peut être potentiellement nocive.
Étendre la transparence aux sources de médicaments et à leurs ingrédients
Les étiquettes des emballages alimentaires doivent contenir le nom, l'adresse et le numéro de téléphone du fabricant à côté de la liste des ingrédients. Ces informations permettent aux consommateurs de contacter directement les fabricants pour se renseigner sur la source des ingrédients du produit et informer l'entreprise de toute réaction connue ou probable aux ingrédients. En cas de rappel, les informations sur la source des aliments fournissent également des informations essentielles aux responsables de la santé publique, leur permettant d'alerter le public sur les produits alimentaires potentiellement contaminés avec spécificité.
Ce n'est pas le cas pour les produits médicaux, même si la source des ingrédients médicamenteux est tout aussi, sinon plus, importante que celle des aliments.
La Loi sur la sécurité et l'innovation de la FDA de 2012 exigeait que les fabricants de médicaments soumettent des informations sur les fournisseurs d'excipients, y compris les noms, adresses et coordonnées. Cependant, comme ces informations sont considérées comme «exclusives» pour le fabricant, elles ne sont pas divulguées publiquement. Bien que la FDASIA ait été une étape vers la transparence de la chaîne d'approvisionnement, elle laisse toujours les patients et les professionnels de la santé sans informations qui pourraient être critiques.
Politiques de transparence potentielles pour améliorer la sécurité des patients
Dans un article de recherche étudiant les risques associés aux excipients, mon co-auteur et moi faire trois recommandations principales pour améliorer la sécurité des patients.
Premièrement, les exigences de déclaration similaires à celles applicables aux aliments et aux ingrédients pharmaceutiques actifs devraient s'étendre aux excipients. Deuxièmement, les cliniciens et les patients devraient avoir un accès facile à ces informations, y compris les quantités et les effets indésirables potentiels. Le public doit également recevoir des informations sur la manière de signaler de manière complète et précise les événements indésirables liés aux excipients. Troisièmement, les organismes de réglementation devraient fournir des orientations pour la déclaration des excipients, facilitant une plus grande transparence sur l'utilisation des excipients et la source d'approvisionnement.![]()
À propos de l’auteur
Yelena Ionova, stagiaire postdoctorale en qualité des produits médicaux, Université de Californie, San Francisco
Cet article est republié de The Conversation sous une licence Creative Commons. Lis le article original.
book_supplements