
Illustration par McCall Sarrett
Qu'il s'agisse d'oublier des années 20 de votre vie ou d'avoir la même conversation toutes les cinq minutes pour l'oublier à chaque fois, les troubles de la mémoire peuvent avoir de lourdes conséquences sur la vie quotidienne. Il peut s’agir de l’un des aspects les plus déroutants de la neurodégénérescence et est un symptôme clé de la démence.
La maladie d'Alzheimer, aussi connu sous le nom AD, est la forme la plus courante de démence caractérisée par des difficultés cognitives et une perte de mémoire. À l'heure actuelle, il n'existe pas de technique clinique officielle pour le diagnostic de la MA, à l'exception de l'autopsie. Cependant, il existe deux caractéristiques du tissu cérébral des patients atteints de la maladie d'Alzheimer: amyloïde bêta (UN?) des plaques et des enchevêtrements neurofibrillaires, qui ont tous deux fourni un aperçu considérable de la pathologie de la neurodégénérescence.
"Les enchevêtrements neurofibrillaires proviennent d'un défaut dans les protéines appelées protéines tau."
UN? est une protéine qui résulte de protéolyse of Protéine Précurseur Amyloïde (APP). Cela signifie que l'APP est découpé en fragments plus petits, dont l'un est le A ? fragment. L'APP est découpée en ces morceaux par des enzymes appelées sécrétases, dont le rôle principal est de cliver ces protéines. Il existe diverses sécrétases, mais il en est une qui est importante pour la pathologie d'Alzheimer : la gamma sécrétase. La gamma sécrétase produit une forme spéciale de A?: A?-42, la forme la plus toxique de la protéine. Une fois brisés, ces fragments de protéines commencent à se rassembler dans l’espace extérieur aux cellules. La clé de la toxicité de ces protéines est qu’elles sont typiquement « collantes », elles commencent donc à former des agrégats. Ces agrégats continuent de se développer et bientôt ces plaques bêta-amyloïdes sont omniprésentes, altérant grandement la fonction neuronale.
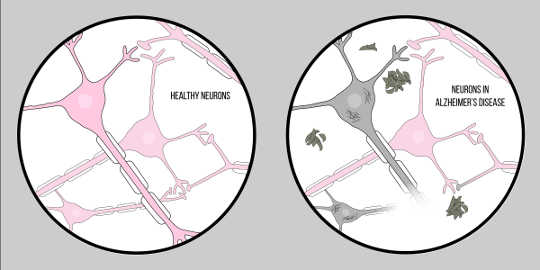 Figure de McCall Sarrett
Figure de McCall Sarrett
Cet impact de A? sur la fonction neurologique a conduit à Hypothèse Amyloïde, une théorie bien reconnue proposant une explication de la neurodégénérescence dans la maladie d’Alzheimer.
Passons maintenant à la deuxième caractéristique clé: les enchevêtrements neurofibrillaires. Les enchevêtrements neurofibrillaires proviennent d'un défaut dans les protéines appelées protéines tau. Les protéines Tau servent de pont entre les structures appelées microtubules dans la cellule. Les microtubules sont des molécules de soutien qui donnent forme et structure aux cellules, en particulier aux axones. Les protéines Tau aident ces microtubules à structurer les axones. Cependant, dans le cas de La maladie d'AlzheimerMaladie neurodégénérative caractérisée par une perte neuronale, les protéines tau se séparent et s'accumulent dans le corps cellulaire, également appelé soma. Cela provoque une dégénérescence des axones, ce qui rend encore plus difficile la communication entre neurones. Cette difficulté de communication neuronale est similaire aux effets de la bêta-amyloïde; Cependant, il est important de noter que ces enchevêtrements diffèrent grandement des plaques discutées précédemment en ce sens qu'ils influencent la communication depuis l'intérieur de la cellule plutôt que vers l'extérieur.
"Les scientifiques ne savent toujours pas quel mécanisme exact est responsable de la pathologie de la maladie d'Alzheimer."
Bien que les deux soient extrêmement influents, A ? et tau ne sont pas les seuls facteurs pertinents lorsqu'il s'agit de la pathologie d'Alzheimer. Des études ont suggéré que l'apolipoprotéine E (APOE) gène peut être aussi influent que A ?. Il existe trois variantes principales codant pour les protéines : ApoE2, ApoE3 et ApoE4. Il a été démontré que l'ApoE4 est en corrélation avec une diminution de l'élagage synaptique, tandis que l'ApoE2 entraîne une augmentation. Les deux formes influencent astrocytes (important cellules gliales dans le système nerveux) et sont corrélés à leur taux de phagocytose, processus par lequel la astrocytesLes cellules gliales en forme d'étoile qui remplissent un certain nombre de fonctions englobent le matériel cellulaire. Chaque variante de ApoE influence directement ce taux de phagocytose, ApoE2, entraînant une augmentation, et ApoE4, une diminution. Cela suggère que les astrocytes sont moins en mesure de «nettoyer» les débris flottant dans la cellule lorsqu’ils sont corrélés avec ApoE4. Ainsi, lorsque ces plaques s'accumulent, le génotype ApoE4 peut empêcher la clairance de ces agrégats, contribuant à la dégénérescence.
La bêta-amyloïde, la protéine tau et divers gènes agissent tous ensemble pour causer un problème de communication majeur entre les cellules, qui est essentiellement la maladie que nous connaissons sous le nom d'Alzheimer. Une telle neurodégénérescence est plus courante dans les zones du cerveau associées à l'apprentissage et à la mémoire, mais finit par se propager à l'ensemble du cerveau. Ce manque de communication entraîne une perte de synapses et, éventuellement, une diminution de la matière cérébrale. Ainsi, il est normal de voir une diminution du tissu cérébral sur une MRIL'imagerie par résonance magnétique, une technique permettant de visualiser l'évolution de la maladie, révélant que la maladie d'Alzheimer rétrécit littéralement le cerveau. Nos modèles actuels d'apprentissage et de mémoire indiquent que les synapses jouent un rôle clé dans ces processus, fournissant une explication possible du lien entre cette pathologie et les principaux symptômes de la MA, tels que la perte de mémoire.
Les scientifiques ne savent toujours pas quel est le mécanisme exact responsable de la pathologie de la maladie d'Alzheimer. De nombreuses méthodes innovantes ont été recherchées dans le but d’approfondir nos connaissances sur ce point pathologique, notamment les biomarqueurs du liquide céphalorachidien (LCR).
Niveaux de A ? et tau peuvent être mesurés dans le LCR grâce à une procédure appelée ponction lombaire, qui recueille le liquide céphalo-rachidien. Des niveaux accrus de tau et des niveaux réduits de A ? sont observés chez les patients atteints de la maladie d'Alzheimer. C'est le résultat du A? accumulations dans le cerveau, ce qui entraîne une diminution de la concentration dans le LCR. Ces données suggèrent qu'à l'avenir, les médecins et les scientifiques pourront peut-être prédire l'état cognitif d'un patient en examinant les niveaux de protéines dans le LCR.
Il n'existe actuellement aucun traitement définitif contre la maladie d'Alzheimer. Cependant, la connaissance croissante des protéines pathologiques impliquées, des gènes associés et les recherches scientifiques en cours permettent d'espérer un traitement efficace dans le futur.
Selon vous, quelle avancée est nécessaire pour que les médicaments permettent de traiter efficacement la maladie d'Alzheimer? Faites le nous savoir dans les commentaires!
Cet article a paru sur Connaissant les neurones?
A propos de l'auteur
Khayla Black est une étudiante de première année à l’Université de New York à Shanghai. Elle envisage de se spécialiser en sciences neurologiques avec une mineure en sciences des données avec concentration en intelligence artificielle. À l'avenir, elle espère obtenir un doctorat en médecine et devenir une neuroscientifique qui étudie les aspects moléculaires de l'apprentissage et de la mémoire. Dans ses temps libres, Khayla aime travailler avec l’initiative MYELIN au sein d’IYNA et lire tout le matériel lié aux neurosciences. En dehors de ses études en neurosciences, elle aime courir, enseigner dans les écoles élémentaires locales, résoudre des problèmes de calcul et boire d’immenses quantités de café.
Livres connexes
at Marché InnerSelf et Amazon
Bibliographie
Lacor, PN, Buniel, MC, Furlow, PW, Clemente, AS, Velasco, PT, Wood, M., . . . Klein, WL (2007, 24 janvier). UN? Aberrations induites par les oligomères Synapse La composition, la forme et la densité fournissent une base moléculaire à la perte de connectivité dans la maladie d'Alzheimer. Récupéré de http://www.jneurosci.org/content/27/4/796
Murphy, député et LeVine, H. (2010). La maladie d'Alzheimer et le peptide ?-Amyloïde. Journal de la maladie d'Alzheimer ? : JAD, 19(1), 311. http://doi.org/10.3233/JAD-2010-1221
O'Brien, RJ et Wong, PC (2011). Traitement des protéines précurseurs amyloïdes et maladie d'Alzheimer. Revue annuelle des neurosciences, 34185-204. http://doi.org/10.1146/annurev-neuro-061010-113613
Chung, W.-S., Verghese, PB, Chakraborty, C., Joung, J., Hyman, BT, Ulrich, JD,… Barres, BA (2016). Nouveau rôle dépendant de l’allèle pour APOE dans le contrôle du taux de synapseConnexions entre neurones où un signal est transmis ... élagage par les astrocytes. Actes de l'Académie nationale des sciences des États-Unis d'Amérique, 113(36), 10186-10191. http://doi.org/10.1073/pnas.1609896113
Zetterberg, H. (2009 août 19). Amyloïde ? et APP comme biomarqueurs de la maladie d'Alzheimer. Récupéré de https://www.sciencedirect.com/science/article/pii/S0531556509001594?via=ihub























